2024.11.25
【プレスリリース】バンコマイシン耐性腸球菌(VRE)感染症の治療に道 -ナトリウムポンプ阻害剤の発見とその阻害機構を解明-
千葉大学大学院理学研究院(膜タンパク質研究センター兼任)の村田武士教授、鈴木花野特任助教、真菌医学研究センターの後藤義幸准教授らは、高エネルギー加速器研究機構(KEK)物質構造科学研究所、自然科学研究機構分子科学研究所、京都大学大学院医学研究科、群馬大学大学院医学系研究科、横浜市立大学大学院生命医科学研究科との共同研究により、バンコマイシンを含む多くの抗生物質に耐性を持つバンコマイシン耐性腸球菌(Vancomycin-resistant Enterococcus faecium :VRE注1))感染症に対する新たな治療法の可能性を開きました。
研究チームは、VREのアルカリ環境での生育に必須となるナトリウムポンプ(Na+輸送性VoV1-ATPase)注2)の阻害剤「V-161」を同定しました。そして、V-161の投与によりマウス小腸でのVREの定着が抑制されることを発見しました。さらに、ナトリウムポンプとV-161の結合部位の詳細な立体構造を解明し、ナトリウム輸送の仕組みとV-161による阻害の仕組みを明らかにしました。
本研究成果は、VREばかりでなく、薬剤耐性菌による多くの感染症に対する効果的な抗菌薬の開発にも貢献することが期待されます。この研究は2024年11月21日に英国科学誌 『Nature Structural & Molecular Biology』 でオンライン速報版として発表されました。
研究の背景と経緯
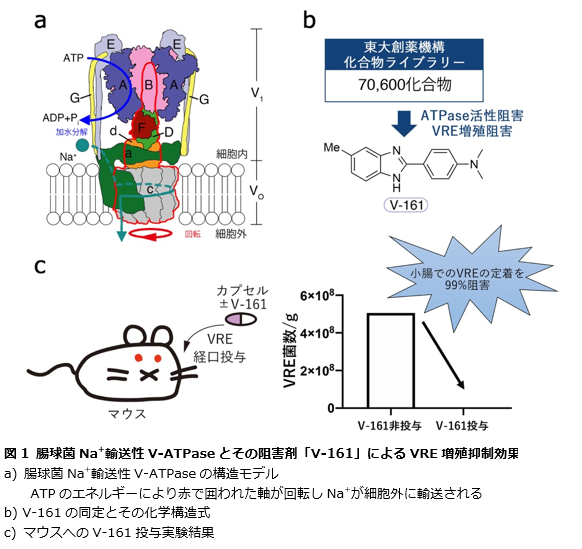
薬剤耐性菌の増加は国際社会の持続的な懸念となっており、その対処がますます喫緊の課題となっています。世界保健機関(WHO)が公表した優先して研究開発に取り組むべき12種類の薬剤耐性菌のリストにはVREが含まれています。しかしVREに効果を示す抗菌薬は枯渇しつつあるため、VREに対する抗菌薬の開発は急務となっています。
研究チームは、Na+輸送性VoV1-ATPaseがVREの生存に重要な酵素ではないかと予想しました。この酵素は、腸内のアルカリ性環境においてNa+を細胞外に排出するナトリウムポンプとして機能し、細菌の恒常性を維持して生育できるようにしています(図1a)。このタンパク質は、アルカリ環境で生育できる多くの病原菌に存在する一方で、動植物や乳酸菌・ビフィズス菌などの善玉菌には存在していないため、これを阻害する化合物は新たな抗菌薬になる可能性が期待されています。そこで、このNa+輸送性VoV1-ATPaseの機能を阻害する化合物を見つけることができれば、VREの増殖を抑制できるのではないかと考え、広範な化合物ライブラリーから阻害剤を探索しました。
研究成果

東京大学が保有する約7万種類の化合物ライブラリーから、腸球菌Na+輸送性VoV1-ATPase活性を抑制する化合物をスクリーニングし、VRE増殖抑制活性が優れたV-161を特定しました(図1b)。この化合物は、試験管実験ではアルカリ性環境下(pH 8以上)でのVREの増殖を強力に抑制する反面、酸性や中性の環境下では影響を与えませんでした。また、V-161は、Na+輸送性VoV1-ATPaseの遺伝子を持たない人間の細胞や善玉菌として知られる乳酸菌、ビフィズス菌の生育には影響を与えませんでした。加えて、マウスを用いた動物実験では、アルカリ環境の小腸において、V-161の経口投与によりVREの定着を大幅に抑制することが確認されました(図1c)。これらの実験により、V-161が腸内環境におけるVREの増殖を抑制する新たな治療薬となる可能性を示唆しています。
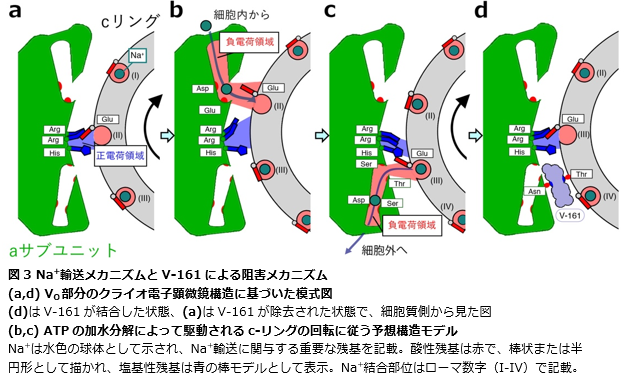
次に、研究チームはクライオ電子顕微鏡注3)を用いた単粒子解析注4)により、V-161存在下でNa+輸送性VoV1-ATPaseのVo部分の構造を高解像度にて解明しました(図2a)。V-161は、Na+輸送経路に関わる重要な部位であるcリングとaサブユニットの界面に結合していました(図2b)。この結合によりcリングの回転運動が阻害されることが予想されました。実際に1分子回転実験注5)でもV-161の添加により酵素の回転運動を完全に停止することが観察されました。
Na+輸送経路は、これまで詳細な構造が不明でした。しかし、本研究でNa+がいかにcリング内で結合(図3 b)・解離し(図3 c)、aサブユニットを介して細胞外に輸送(図3 a-c)されるのか、その具体的なメカニズムが明らかとなりました。
従来の抗菌剤はタンパク質合成阻害や細胞壁合成阻害などの作用で効果を発揮しますが、V-161は従来の抗菌剤の抗菌メカニズムとは全く異なり、直接的にNa+輸送性VoV1-ATPaseの回転運動を制御するため、より効果的かつ選択的な抗菌剤を開発する端緒となる事が期待されます。
今後の展開
今回の研究成果は、VRE治療の分野において画期的な進展をもたらす可能性があります。今後は、V-161の効果をさらに高めるための構造探索を進めるとともに、Na+輸送性VoV1-ATPaseを標的とした他の細菌に対する応用研究も進めていく予定です。さらに、V-161と立体構造情報を基にした治療薬の臨床試験に向けた準備が進められ、薬剤耐性菌との戦いに新たな武器が加わることが期待されます。
また、今回の構造解析により得られた知見は、他の難治性細菌に対する治療法の開発にも応用できる可能性があり、今後の治療薬開発において重要な指針となる大きな一歩と言えます。VREのみならず、広範な薬剤耐性菌に対応できる画期的な治療法を開発し、医療現場における薬剤耐性菌感染症の治療法が大きく前進することを期待しています。
研究プロジェクトについて
本研究は、JST戦略的創造研究推進事業「さきがけ」や、AMED創薬等先端技術支援基盤プラットフォーム(BINDS)、新興・再興感染症に対する革新的医薬品等開発推進研究事業、科研費等の支援を受けて行われました。
用語解説
注1)バンコマイシン耐性腸球菌(VRE)
院内感染の原因菌として知られている薬剤耐性菌の一種で、心内膜炎や敗血症などの日和見感染を引き起こし、深刻な問題になっている。
注2)ナトリウムポンプ(Na+輸送性VoV1-ATPase)
一部の細菌の細胞膜に存在するタンパク質であり、ATP(アデノシン三リン酸)をエネルギー源として利用して細胞内のナトリウムイオン(Na+)を排出するナトリウムポンプとして機能する。これにより、細菌は正常な機能を維持し、特にアルカリ環境で増殖するために重要な役割を果たしている。
注3)クライオ電子顕微鏡
極低温で急速に凍らせたタンパク質試料を極低温状態に保ったまま電子線写真を撮影することのできる透過型顕微鏡。
注4)単粒子解析
クライオ電子顕微鏡で取得した様々な投影方向を持つ粒子の2次元の投影像を使って、粒子の3次元構造を再構成する手法。まず、様々な2次元の投影画像の位置や向きを調整し、粒子の投影方向を推測する。次にこれらの情報を用いて逆投影を行い、3次元構造を組み立てる。この方法により、タンパク質分子の構造を観察できる。
注5)1分子回転実験
回転分子モーターの回転運動を1分子レベルで解析する実験。Na+輸送性VoV1-ATPaseの回転子(Vo-cリング)を固定し、固定子(V1-Aサブユニット)に金ナノ粒子を取り付け、レーザー顕微鏡を用いてATP添加による1分子の回転運動を直接観察できる。この回転運動はV-161添加により完全に停止した。
論文情報
研究に関するお問い合わせ
- 千葉大学 大学院理学研究院 教授 村田 武士
E-mail:[email protected]
広報に関するお問い合わせ
- 千葉大学 広報室
TEL:043-290-2018 E-mail:koho-press@chiba-u.jp - 高エネルギー加速器研究機構 広報室
TEL: 029-879-6047 E-mail:[email protected] - 自然科学研究機構 分子科学研究所 研究力強化戦略室 広報担当
TEL:0564-55-7209 E-mail:[email protected] - 総合研究大学院大学 総合企画課 広報社会連携係
TEL:046-858-1629 E-mail:[email protected]
